「警告・禁忌を含む注意事項等情報」等は電子添文をご参照ください。
国内第Ⅲ相臨床試験
(IM011-066試験) POETYK PSO-4
社内資料:国内第Ⅲ相試験(IM011-066試験)[POETYK PSO-4](承認時評価資料)
有効性・安全性については、試験概要をご確認後、ページ下部へのスクロールにてご確認いただけます。
試験概要
- 目的
-
中等症から重症の安定した局面型皮疹を有する乾癬患者(関節症性乾癬の有無を問わない)、汎発型膿疱性乾癬患者、乾癬性紅皮症患者を対象に、投与16週のPASI 75及びsPGA 0/1達成率により、ソーティクツの有効性及び安全性を検討する。
- 対象
-
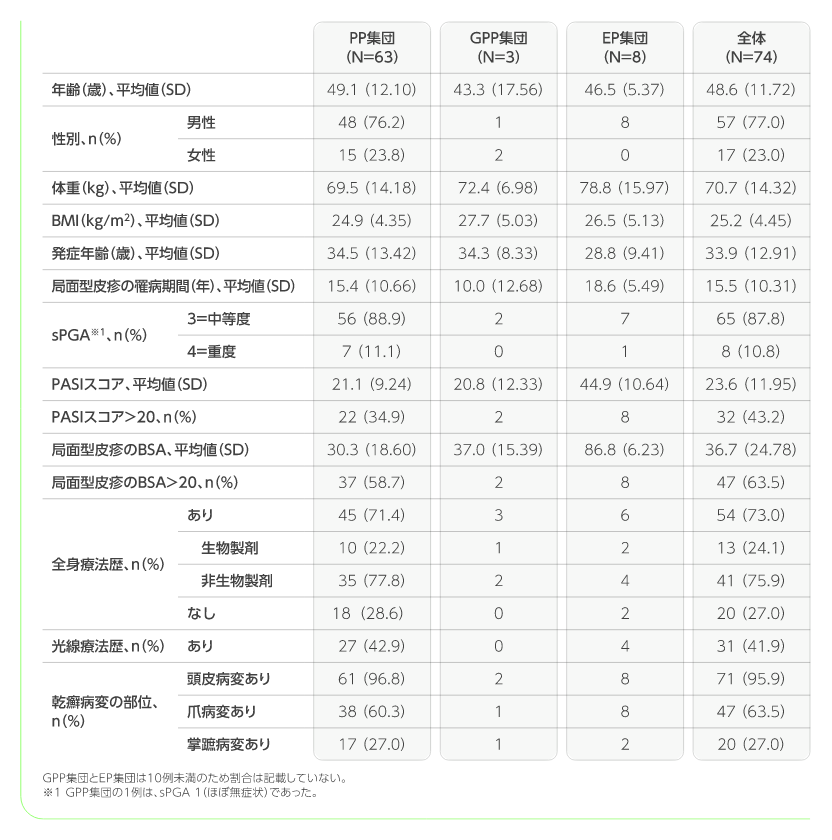
中等症から重症の局面型皮疹を有する乾癬患者(PP集団)63例、汎発型膿疱性乾癬患者(GPP集団)3例、乾癬性紅皮症患者(EP集団)8例、全体74例(日本人以外のデータが1例含まれる)
局面型皮疹を有する乾癬患者(PP集団)- ・ BSA10%以上、PASIスコアが12以上、かつsPGAスコアが3以上の中等症から重症の局面型皮疹を有する患者(CASPAR基準により診断された関節症性乾癬患者を含む)
- ・ 6ヵ月以上にわたり、形態学的変化又は重大な再燃が認められない安定した局面型皮疹を有する乾癬がある患者
膿疱性乾癬患者(GPP集団) - ・ JDA基準により診断された汎発型膿疱性乾癬の併発又は既往歴があり、BSA10%以上の膿疱を伴う紅斑性病変部(皮膚症状スコア2以上)を有する患者のうち、スクリーニング来院時点のJDA重症度指標スコア14未満、Day1前2週間以上にわたり安定した治療レジメンを受けている患者
乾癬性紅皮症患者(EP集団) - ・ 乾癬性紅皮症の併発又は既往歴を有する、又は局面型皮疹を有する乾癬の既往歴があり、BSA80%以上の病変を有する患者
- 試験デザイン
-
多施設共同、単一群、オープンラベル試験
- 試験方法
-
ソーティクツ(6mg1日1回)を52週間経口投与した。
- 評価項目
-
-
主要評価項目
・ 投与16週のPASI 75及びsPGA 0/1達成率
-
その他の評価項目
・ PP、GPP又はEP集団における投与52週までのPASI 75、PASI 90、PASI 100、sPGA 0/1、sPGA 0達成率 等 ・GPP又はEP集団における投与52週までのGISのベースラインからの変化量 ・GPP集団における投与52週までのJDA総スコアのベースラインからの変化量
-
安全性評価項目
・有害事象 等
-
- 解析計画
-
本試験の有効性解析には、以下の解析対象集団を用いた。
・As-treated集団:治験薬を1回以上投与された患者集団 ・PP集団:局面型皮疹を有する乾癬を有するAs-treated集団の部分集団 ・GPP集団:膿疱性乾癬を有するAs-treated集団の部分集団 ・EP集団:乾癬性紅皮症を有するAs-treated集団の部分集団
本試験は単群試験であるため、主要評価項目及びその他の評価項目において群間比較のための統計学的検定は実施しなかった。
二値変数は度数及び割合を用いて要約した。連続変数は、特に明記しない限り、患者数、平均値、標準偏差(SD)、中央値、最小値、最大値を用いて要約した。有効性評価項目は、全ての評価時点のPASI 75、sPGA 0/1達成率を要約した。また、主な評価時点である投与16週と最終評価時点の52週のPASI 75、PASI 90、PASI 100、sPGA 0/1、sPGA 0達成率、GISスコア変化量(GPP集団とEP集団)、JDA総スコア変化量(GPP集団のみ)を要約した。
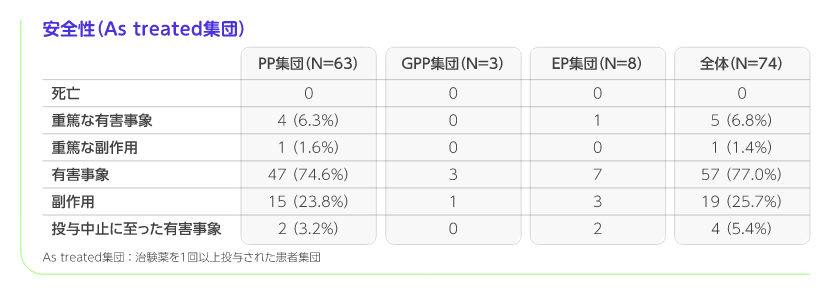
安全性評価項目は有害事象、死亡、重篤な有害事象、投与中止に至った有害事象などの頻度及び割合を要約した。
患者背景
有効性
投与16週のPASI 75達成率、sPGA 0/1達成率[主要評価項目]
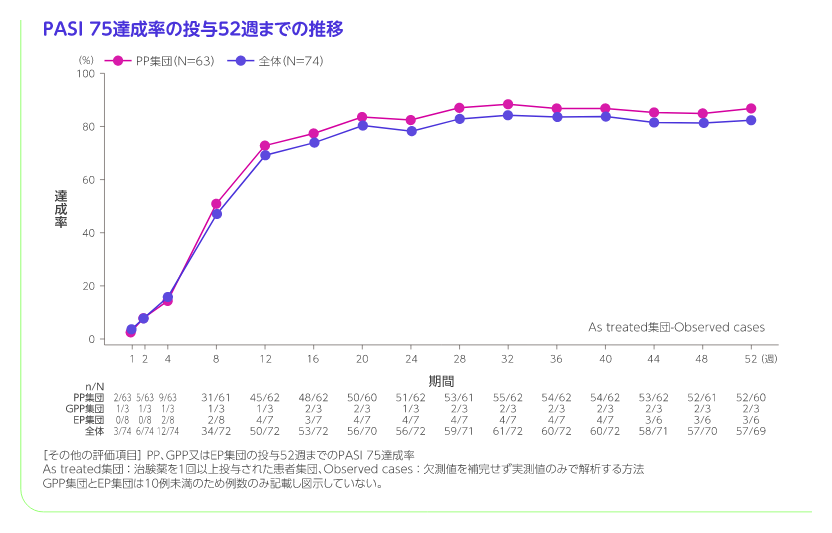
投与16週のPASI 75達成率は全体で71.6%(53/74例)、PP集団で76.2%(48/63例)であり、GPP集団で2/3例、EP集団で3/8例がPASI 75を達成しました。
投与16週のsPGA 0/1達成率は全体で75.7%(56/74例)、PP集団で82.5%(52/63例)であり、EP集団で4/8例がsPGA 0/1を達成し、GPP集団ではsPGA 0/1達成は認められませんでした。
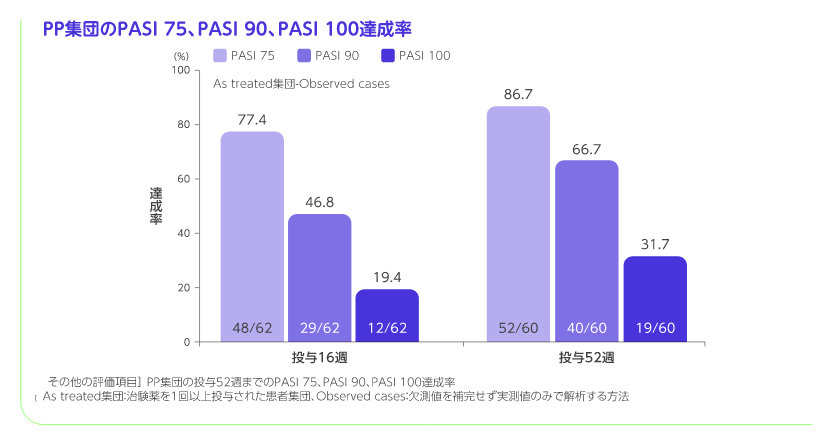
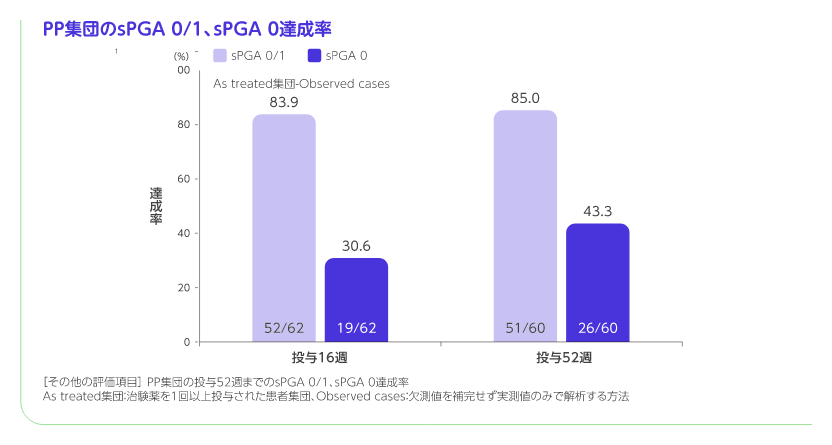
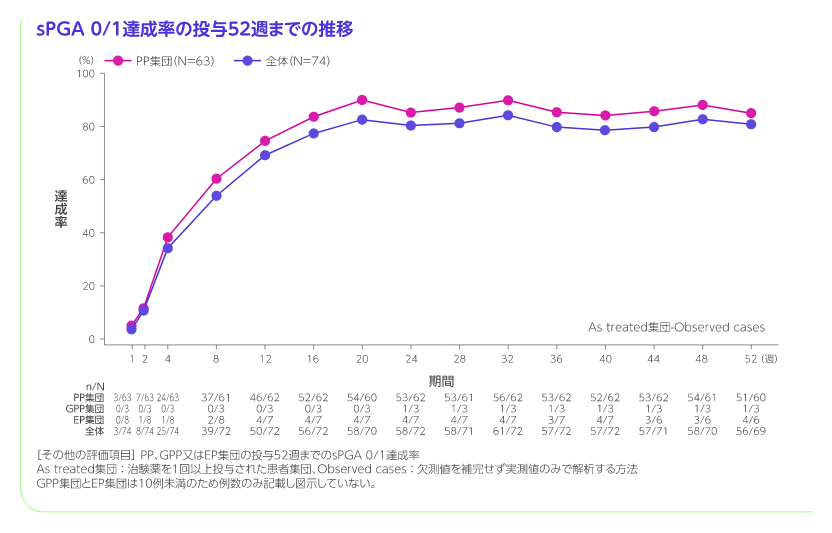
PP集団の投与52週までのPASI 75、PASI 90、PASI 100、sPGA 0/1、sPGA 0達成率[その他の評価項目]
PP集団におけるPASI 75達成率は投与16週では77.4%、投与52週では86.7%でした。同様にsPGA 0/1達成率は投与16週では83.9%、投与52週では85.0%でした。より厳格な指標であるPASI 90達成率、PASI 100達成率及びsPGA 0達成率は以下のとおりでした。
GPP又はEP集団における投与52週までのGISのベースラインからの変化量/GPP集団における投与52週までのJDA総スコアのベースラインからの変化量
[その他の評価項目]
投与52週までにGPP集団3例及びEP集団8例におけるGIS、GPP集団3例におけるJDA総スコアは以下のように変化しました。
安全性
- 再生時間:
- 約6分
RELATED CONTENTS 関連コンテンツ